15支問題注射液在海南已售出使用 暫未收到不良反應報告
有媒體報道稱,江蘇蘇中藥業股份有限公司生產的生脈注射液在廣東省發生不良事件,個別患者用藥后出現寒戰、發熱癥狀。經查,江蘇蘇中藥業集團股份有限公司生產的涉事批次生脈注射液批號為14081413,2014年8月14日生產,有效期至2016年8月13日,總計37638支,其中銷往海南的有15支。
4月25日下午,記者從海南省食品藥品監督管理局獲悉,海南某醫療機構購買了江蘇蘇中藥業股份有限公司生產的生脈注射液5盒共15支,藥品已經售出使用,但海南省藥品不良反應監測中心目前沒有收到藥品不良反應報告。
此前消息:江蘇蘇中藥業3萬多支問題"生脈注射液"流入海南等9省區
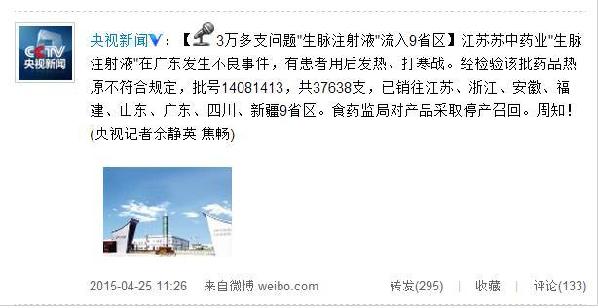
?
微博截圖
近日,江蘇蘇中藥業集團股份有限公司生產的生脈注射液在廣東省發生不良事件,個別患者用藥后出現寒戰、發熱癥狀。經廣東省食品藥品檢驗所檢驗,該批次藥品熱原不符合規定。江蘇省食品藥品監督管理局已采取對企業進行現場檢查、監督企業暫停該品種生產和銷售、召回問題批次藥品、徹查藥品質量問題原因等措施。同時,組織對該企業同一生產周期相關批次藥品進行檢驗,擴大風險評估范圍,發現問題及時處置。
經查,江蘇蘇中藥業集團股份有限公司生產的涉事批次生脈注射液批號為14081413,2014年8月14日生產,有效期至2016年8月13日,總計37638支。共銷往江蘇(2400支)、浙江(13788支)、安徽(12支)、福建(12支)、山東(417支)、廣東(9954支)、海南(15支)、四川(7200支)、新疆(3840支)等9省(區)。
為保障公眾用藥安全,國家食品藥品監督管理總局要求江蘇省食品藥品監督管理局在做好上述工作的基礎上,監督企業采取有效措施,確保問題藥品全部召回,并監督銷毀;監督企業徹查藥品質量問題原因,針對查明的原因進行整改,在未查明原因、未整改到位之前不得恢復生產,恢復生產需報總局備案;對企業存在的違法違規行為依法立案查處。問題藥品流入地的省(區)食品藥品監督管理部門要密切關注藥品流通使用情況,并監督相關企業配合召回問題藥品。藥品不良反應監測機構要加強監測,發現不良事件及時報告。
總局要求地方各級食品藥品監管部門必須以對人民群眾高度負責的態度,全面履行監督責任,對藥品質量問題絕不放過,對違法違規企業絕不手軟。藥品生產企業要吸取這一事件的教訓,嚴格藥品生產質量管理,嚴把藥品質量關,切實承擔起藥品安全主體責任。
盤點:近兩年出現哪些問題“注射液”?
時間:2015年2月
地點:山東
現象:注射液含類似毛發狀異物
通告稱,長春市一診所日前發現山東齊都藥業有限公司生產的鹽酸左氧氟沙星氯化鈉注射液有類似毛發狀異物,事發后涉事產品被該公司業務員銷毀,但有關證據證明涉事產品確實存在上述問題,山東齊都藥業有限公司承認以上事實。
時間:2014年8月
地點:湖北
現象:連續出現23例發熱、過敏等嚴重不良反應
2014年8月12日國家食品藥品監督管理總局收到報告,反映湖北同濟奔達鄂北制藥有限公司生產的核黃素磷酸鈉注射液(批號:201311081)在浙江省連續出現23例發熱、過敏等嚴重不良反應。經寧波市藥檢所檢驗,該批藥品的“無菌、細菌內毒素和可見異物”項不符合規定。
時間:2014年12月
地點:安徽
現象:患者用藥后出現寒戰、發熱癥狀
經查,2014年下半年在河南省也有個別患者使用該企業生產的胞磷膽堿鈉注射液出現寒戰、發熱的病例報告。經檢驗,批號為131228的藥品“可見異物”項不符合規定。此外,2012年和2013年,該企業生產的胞磷膽堿鈉注射液分別各出現一起類似不良事件。
時間:2013年12月
地點:四川
現象:患者用藥后出現寒戰、發熱等不良反應
8月以來,四川升和藥業生產的部分批次丹參注射液在多個省份,致多名患者用藥后出現寒戰、發熱等不良事件。目前,企業已全面停產并深入查找原因。
·凡注明來源為“海口網”的所有文字、圖片、音視頻、美術設計等作品,版權均屬海口網所有。未經本網書面授權,不得進行一切形式的下載、轉載或建立鏡像。
·凡注明為其它來源的信息,均轉載自其它媒體,轉載目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責。








fed111e8-7976-420e-971e-d2cb7a9b1cf5.jpg)
086f6ffe-716d-4d77-b60a-c0561e2b9551.jpg)
bde30562-4991-4fa4-b71c-74912cdd21a1.jpg)
f4597297-fcbc-4658-a350-99eb944743af.jpg)

bf61686e-4481-456c-8946-af0d6769e33f.jpg)

ca0f9aa7-2273-4a8a-9d60-fbd107ad55e2_zsize_watermark.jpg)
79b6258d-f2e5-4334-89d4-7a5f823993fa_zsize_watermark.jpg)
e9717089-0395-40ce-a9f1-96d4465d84cc_zsize_watermark.jpg)
89e16128-ce7d-473b-93ae-34bcf30a9e65_watermark.jpg)


